На скорость химической (газовой) коррозии металлов и сплавов влияют внешние и внутренние факторы.
К внешним факторам относятся состав и давление газовой среды, скорость её движения, температура, режим нагрева.
Состав газовой среды . При высоких температурах металлы взаимодействуют с кислородом, парами воды, оксидом углерода (lV), оксидом серы (lV) по схеме
2М + О 2 = 2МО,
М + СО 2 = МО + СО,
М + Н 2 О = МО + Н 2 ,
3М + SО 2 = 2МО + МS.
Скорости этих химических реакций и защитные свойства образующихся плёнок различны, следовательно, скорости коррозии металлов в указанных средах также различны.
Из экспериментальных данных известно, что при 900 0 С ско-рость окисления Fe, Co, Ni возрастает в ряду
Н 2 О (П) ® СО 2 ® О 2 ® SО 2
В отличие от этих металлов Cu практически не корродирует в атмосфере SO 2 .
В приведенных выше газах скорость газовой коррозии металлов увеличивается в ряду
Cr ® Ni ® Co ® Fe
Вольфрам при 900 0 С наибольшую скорость коррозии имеет в атмосфере О 2 , а наименьшую ─ в СО 2 .
Загрязнение воздуха СО 2 , SО 2 , парами Н 2 О вызывает повышение скорости коррозии малоуглеродистой стали. Это связывают с увеличением несовершенств в оксидной плёнке.
При нагревании стали в атмосфере, содержащей О 2 , СО 2 , Н 2 О, помимо окисления, может происходить обезуглероживание (декарбонизация)
Fe 3 C + 1/2O 2 = 3Fe + CO,
Fe 3 C + CO 2 = 3Fe + 2CO,
Fe 3 C + H 2 O = 3Fe + CO + H 2 .
Наводороживание стали происходит при высоких температурах адсорбированными на её поверхности атомами водорода. При комнатной температуре молекулы Н 2 не диссоциируют, поэтому наводороживания стали не происходит. Наводороживание вызывает резкое уменьшение пластичности, понижает длительную прочность металлов. Склонен к наводороживанию титан.
Температура . Повышение температуры вызывает увеличение константы скорости химической реакции, а также рост скорости диффузии реагентов в плёнке продуктов коррозии. Это приводит к увеличению скорости газовой коррозии металлов и сплавов ─ Fe, Cu, и др.
Температура может оказывать влияние на состав образующихся плёнок и закон их роста (таблица 1).
Большое влияние на скорость окисления оказывает режим нагрева. Колебания температуры при нагреве и особенно попеременный нагрев и охлаждение вызывают разрушение плёнки вследствие возникновения больших внутренних напряжений, в результате чего скорость окисления металлов увеличивается.
Таблица 1 ─ Влияние температуры на состав и закон роста оксид-
ных плёнок
Давление газа . С повышением парциального давления кислорода скорость коррозии металлов возрастает.
Для некоторых металлов и сплавов при постоянной достаточно высокой температуре с увеличением парциального давления кислорода скорость окисления сначала растёт, а затем при достижении некоторого критического значения Ро 2 ─ резко уменьшается (рисунок 7) и в широком диапазоне давлений остаётся достаточно низкой.

Р О 2 КР Р О 2
Рисунок 7 - Влияние парциального давления кислорода на
скорость газовой коррозии
Явление уменьшения скорости газовой коррозии при повышении парциального давления кислорода называют высокотемпературной пассивацией. Пассивное состояние металла связывают с образованием на его поверхности совершенной плёнки.
Высокотемпературную пассивацию имеют хромистые стали, медь, титан, цинк и другие металлы и сплавы.
При значительном увеличении парциального давления кислорода выше критического, у целого ряда нержавеющих сталей, например, 08Х13 (Х13), 30Х13 (Х13), 12Х17 (Х17), 08Х18Н10Т (Х18Н10Т) происходит нарушение пассивного состояния («перепассивация»), что приводит к увеличению скорости окисления.
Увеличение скорости коррозии при высоких температурах может вызвать повышение скорости движения газовой среды.
К внутренним факторам, влияющим на скорость химической коррозии металлов относятся: природа, химический и фазовый состав сплава, механические напряжения и деформация, характер обработки поверхности.
Состав и структура сплава . Скорость окисления сталей при высоких температурах с повышением содержания углерода понижается. Уменьшается обезуглероживание сталей. Это связано с интенсификацией процесса образования оксида углерода (II). Сера и фосфор практически не влияют на скорость окисления стали.
На скорость коррозии стали, в кислородсодержащей среде влияют легирующие элементы. Хром (Cr), алюминий (Al) и кремний (Si) сильно замедляют процесс окисления стали. Это связано с обра-зованием плёнок с высокими защитными свойствами. При содержании приблизительно 30 % Cr, до 10 % Al, до 5 % Si, стали имеют высокую жаростойкость. Меньшее повышение жаростойкости дает легирование стали титаном (Ti), медью (Cu), кобальтом (Со) и бериллием (Be).
Элементы, образующие легкоплавкие или летучие оксиды, например, ванадий (V), молибден (Мо), вольфрам (W) ускоряют оки-сление стали.
Высокой жаростойкостью обладают сплавы никеля (Ni) c хромом (Сr) - нихромы. Типичные нихромы содержат 80 % Ni и 20 % Cr или 65 % Ni, 20 % Cr и 15 % Fe.
Скорость окисления меди (Cu) понижается при её легировании Al, Be, оловом (Sn) и цинком (Zn).
На скорость коррозии влияет также структура сплава . Установлено, что наиболее жаростойкой является сталь с аустенитной (однофазной) структурой. Хромоникелевые стали с двухфазной аустенитно-ферритной структурой менее устойчивы к окислению. С увеличением содержания ферритной составляющей скорость окисления стали повышается. Например, хромоникелевая аустенитная сталь 12Х18Н9Т (Х18Н9Т) имеет более высокую жаростойкость, чем двухфазная сталь Х12Н5Т с более высоким содержанием хрома. Это связывают с тем, что на двухфазных сталях образуются менее совершенные плёнки, чем на однофазных.
Жаростойкость чугуна зависит от формы графитовых выделений. При шаровидной форме графита жаростойкость чугуна выше.
Деформация металлов в процессе нагрева может вызвать нарушение сплошности плёнок и связанное с этим увеличение скорости окисления. Повышенная шероховатость поверхности металла способствует образованию защитных плёнок с дефектами, что ведет к увеличению скорости коррозии.
Лекция 9. Коррозия металлов.
План лекции
1. Коррозия металлов.
2. Химическая и электрохимическая коррозия. Механизм коррозии. Факторы, определяющие интенсивность коррозии.
3. Виды электрохимической коррозии.
4. Методы защиты металлов от коррозии - покрытия.
5. Электрохимические методы защиты. Ингибиторы коррозии.
Задачи изучения темы:
В процессе освоения темы студенты получают представление о процессе коррозии, его механизме, факторах, влияющих на коррозионный процесс. Способы защиты металлов от коррозии.
Студент должен знать:
Природу коррозионных процессов. Основные способы защиты металлов от коррозии, их классификация и механизм действия.
Основная и дополнительная литература
Основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов / Под ред. А.И. Ермакова. – изд. 28-е, перераб. и доп. – М.: Интеграл-Пресс, 2000. – С. 27-36.
2. Ахметов Н.С. Общая и неорганическая химия. М: Высш.шк., 2005. 743 с.
3. Угай Я.А. Общая и неорганическая химия. М: Высш.шк, 2004. 527 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / под ред. В.А. Рабиновича и др. М.: Интеграл-Пресс, 1997. – 240 с.
Дополнительная
5. Некрасов Б.В. Основы общей химии. СПб-М: Высш.шк, 2003 Т. 1, 2.
6. Коровин Н.В. Общая химия. М: Высш.шк., 2005. 557 с.
7. Практикум по общей и неорганической химии: Пособие для студентов вузов. / В.И. Фионов, Т.М. Курохтина, З.Н. Дымова и др.; Под ред. Н.Н. Павлова, В.И. Фролова. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002. – С. 33-47.
Методические разработки кафедры
8. Гаркушин И.К., Лисов Н.И., Немков А.В. Общая химия для технических вузов. Учебное пособие. Самарск. гос. техн. ун-т, Самара. – 2003. – С. 144-166.
9. Жиляева И.И., Громаковская А.Г. Коррозия металлов. Метод. указания к лабораторной работе.
1. КОРРОЗИЯ Corrodere (лат.) – разъедать.
Коррозия это разрушение металла и изделий из-за химического взаимодействия с окружающей средой.
Коррозия - окислительно-восстановительный гетерогенный процесс, протекающий на поверхности раздела фаз – металл/жидкость, металл/газ. Это самопроизвольный процесс, приводящий к получению термодинамически более устойчивых соединений.
Ежегодные потери металла из-за коррозии составляют 10 – 12% производственных мировых запасов.
Основные виды коррозии разделяют :
По механизму протекания коррозии:
Химическая – протекает в неэлектролитах – гетерогенное взаимодействие металла с окислителем окружающей среды (газовая, неэлектролитная);
Электрохимическая – протекает в электролитах – взаимодействие металла с окислителем включает анодное растворение металла и катодное восстановление окислителя (электролитная, влажно-атмосферная, почвенная)
По характеру разрушения поверхности металла :
Равномерная (общая) – распределяется более или менее равномерно по всей поверхности металла;
Местная – пятнами (язвами);
Точечная (на поверхности) или питтинг (на большой глубине);
Межкристаллитная – по границам зерен (самая опасная – ослабевают связи между зернами структуры сплава);
Подповерхностная – незаметная (под поверхностью металла);
Избирательная – растворение одного из компонентов сплава;
Растрескивание – при одновременном воздействии химических реагентов и высоких механических напряжений;
Селективная – избирательная.
Рассмотрим более подробно химическую и электрохимическую коррозии:
2. ХИМИЧЕСКАЯ КОРРОЗИЯ
Сущность химической коррозии – в окислении металла в результате химического взаимодействия его с окружающей средой.
Среды вызывающие химическое разрушение металла называются агрессивными.
Химическая коррозия осуществляется путем непосредственной передачи электрона от атома металла к атому окислителя.
Химическую коррозию подразделяют на газовую и неэлектролитную (жидкостная неэлектролитная коррозия).
Жидкостная неэлектролитная коррозия развивается при эксплуатации химического оборудования, соприкосновения с нефтью и ее продуктами, жидким бромом, бензином, керосином и др. органикой, т.е. веществами, не проводящими электрический ток.
Коррозия в газах (газовая коррозия наиболее распространенная) происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т.п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др. (так например диоксид серы присутствующий в заводских помещениях под действием температуры окисляется образую триоксид серы, который вступает а реакцию с металлом, тем самым разрушая ее)
С повышением температуры скорость газовой коррозии возрастает.
Частный случай газовой коррозии – водородная коррозия (водород связывает углерод находящийся в стали в непредельные углеводороды – метан и т.д.)
Fe 3 C (цементит) + 2H 2 3Fe + CH 4
Карбонильная – Me + nCO Me(CO)n
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде не ржавеет. Но обыкновенные металлы всегда содержат различные примеси, что создает благоприятные условия для коррозии.
На ряде металлов образуется тонкий слой оксида.
В качестве примера на рисунке показано образование оксидов на поверхности металла:
Если пленка прочно связана с поверхностью металла и не имеет механических повреждений, то она защищает металл от дальнейшего окисления. Такие защитные пленки имеются у алюминия, хрома, цинка, марганца, титана, ванадия, никеля и кобальта. Для того чтобы оксидная пленка защищала металл, она должна быть сплошной, обладать высокой адгезией, быть устойчивой к агрессивным средам, обладать коэффициентом термического расширения близким к этому показателю металла.
У железа она пористая, легко отделяется от поверхности и поэтому не способна защитить металл от разрушения.
Для изготовления аппаратуры, подвергающейся действию коррозионно-активных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, никель, алюминий; применяются также сплавы на основе никеля или кобальта.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимическая коррозия возникает при контакте двух разнородных металлов (или примеси неметаллов) в среде электролита.
В отличие от химической коррозии, передача электронов идет через токопроводящую среду – электролит. Коррозия протекает в местах контактов металлов, имеющих разные электродные потенциалы, которые выполняют роль электродов.
Во всех случаях различной неоднородности на поверхности металла самопроизвольно возникают локальные микрогальванические элементы – гальванопары.
При гальванокоррозии поток электронов направлен от более активного металла к менее и более активный металл разрушается. При возникновении гальвано пары появляется ток тем большей силы, чем дальше отстоят металлы в ряду напряжений.
Скорость электрохимической коррозии зависит от природы металла, природы электролита и температуры.
Скорость коррозии металла повышается также при включении в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков, в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла и также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствует образованию на ней защитных слоев.
Виды электрохимической коррозии
Наиболее характерные виды электрохимической коррозии:
Атмосферная – протекает во влажном воздухе при обычной температуре. Поверхность металла покрывается пленкой влаги, содержащей растворенный кислород. Интенсивность коррозии возрастает с увеличением влажности воздуха, содержания в нем газообразных СО 2 и SO 2 , пыли, копоти, а также при наличии на поверхности металла шероховатостей и трещин, облегчающих конденсацию влаги.
Различают: сухую атмосферную коррозию, протекающую при относительной влажности 60%, под действием кислорода, и мокрую атм. коррозию – разрушение металлических конструкций под действием дождя, снега и туманов.
Почвенная – металлы соприкасаются с влагой почвы, содержащей растворенный кислород. Анодному разрушению подвергаются участки с большей увлажненностью и меньшим доступом воздуха. Особенно коррозионно-активны почвы с высокой влажностью, кислотностью и электрической проводимостью. Поэтому на скорость газовой коррозии влияют следующие характеристики – пористость, рН, электропроводность, наличие растворенных солей.
В таких условиях трубопроводы разрушаются в течение полугода после их укладки, если не принимаются специальные меры для из защиты.
Морская коррозия – это коррозия в морской воде, агрессивность которой обусловлена содержанием кислорода и наличием в ней хлоридов металлов, препятствующих образованию эффективных защитных пленок. Наиболее сильно она протекает на границы воды и атмосферы.
Электрокоррозия – происходит под действием блуждающих токов, возникающих от посторонних источников (линии электропередач, электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе) от которых через недостаточную электроизоляцию ток может истекать в грунт. Блуждающий ток, попав на находящийся в земле металлический предмет, в некотором месте выходит в грунт, вызывая разрушение места выхода – которое называется анодным выходом, где наблюдается очень интенсивная коррозия. Блуждающие токи вызывают коррозию газопроводов, нефтепроводов, электрокабелей, различных подземных металлических сооружений.
4. МЕТОДЫ БОРЬБЫ С КОРРОЗИЕЙ
Изоляция металлов от агрессивной среды (ПОКРЫТИЯ) :
Металлические покрытия – покрытие защищаемого металла слоем другого металла, практически не корродирующего в тех же условиях.
При покрытии изделия различными металлами надо помнить, что покрытие и защищаемый металл могут образовывать гальваническую пару. Ее работа в определенных условиях может либо усиливать защитное действие, либо наоборот усиливать коррозию защищаемого металла.
Анодное покрытие . Например при локальном нарушении цинкого покрытия в гальвано паре цинк–железо анодом будет цинк, который и будет разрушаться, защищая железо.
Катодное покрытие . А в паре олово–железо при нарушении оловянного покрытия разрушению будет подвергаться железо, т.к. в этой паре именно оно является анодом.
Различия коррозиционной стойкости покрытий в тех или иных агрессивных средах и свойства конечных продуктов коррозии определяют специфические области применения этих покрытий.
Неметаллические покрытия – пленки высокополимерных веществ (каучуки, пластмассы), лаки, олифа, композиции из высокополимерных и неорганических красящих веществ.
Покрытие резиной называется – гуммирование, а бетоном – торкретирование
90% всех металлических изделий защищают подобным образом. Дешевы, их просто наносить, но они не прочны.
Химические покрытия(более надежны):
пленки из оксидов металлов (толщиной 0,3 микрона), получаемые при действии кислорода или подходящих окислителей (HNO 3 , K 2 Cr 2 O 7 и др.) на поверхность металлов. Часто такие оксидные пленки образуются на поверхности металлов просто при соприкосновении с воздухом, что делает химически сравнительно активные металлы (Zn, Al) практически коррозионно-стойкими;
подобную же роль могут играть защитные нитридные пленки, образующиеся при действии азота или аммиака на поверхность некоторых металлов;
искусственное оксидирование (толщиной до 30 микрон), азотирование и фосфатирование, причем лакокрасочные покрытия наносятся на оксидированный, азотированный и фосфатированный металл.
Так оксидирование железа (выроненная сталь) проводят в смеси гидроксида натрия (800г/л) с нитратом (50г/л) и нитритом (200г/л) натрия при температуре 140 о С.
Оксидирование железа приводит к формированию на его поверхности пленок Fe 3 O 4 – черного цвета или Fe 2 O 3 – коричневого цвета.
А для фосфатирования применяют фосфаты марганца и железа, которые приводят к формированию трудно растворимых пленок трехвалентного железа.
Фосфатные и оксидные пленки нередко используют как электроизоляционные покрытия, например на трансформаторных пластинах (пробивное напряжение таких пленок может достигать 600 В).
5. Электрохимические методы защиты – основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды.
катодная (электрозащита) – защищаемая конструкция, находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества (к отрицательному полюсу). В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединенный к аноду внешнего источника электричества. Фактически он служит источником электронов, поставляемых на катод. В процессе коррозии этот кусок старого металла разрушается.
| Катодная защита |
 |
протекторная (анодная) – используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (Zn, Mg). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии разрушается протектор.
Этот метод применяется для защиты от коррозии лопастей турбин подводных частей кораблей, для защиты холодильного оборудования, работающего с солевыми продуктами.
Воздействие на агрессивную среду
Для замедления коррозии металлических изделий в агрессивную среду вводят вещества (чаще всего органические), называемые ингибиторами коррозии, которые пассивируют поверхность металла и препятствуют развитию коррозионных процессов. Это имеет большое значение в тех случаях, когда металл необходимо защищать от разъедания кислотами. Ингибиторы коррозии широко применяют при химической очистке паровых котлов от накипи, для снятия окалины с отработанных изделий, а также при хранении и перевозке HCl в стальной таре. В качестве органических ингибиторов коррозии применяют тиомочевину (сульфид-диамид углерода C(NH 2) 2 S), диэтиламин, уротропин (гексаметилентетрамин (CH 2) 6 N 4) и другие производные аминов, а в качестве неорганических – силикаты, нитриты, дихроматы щелочных металлов и др.
К этой же группе методов защиты металлов от коррозии относится также освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Лекция 4.
Электрохимическая коррозия представляет собой самопроизвольное разрушение металлов в результате электрохимического взаимодействия с жидкими электролитами, обладающими электропроводностью. Такими электролитами могут быть вода, водные растворы кислот, щелочей, расплавленные соли. Электрохимическая коррозия широко распространена и имеет много разновидностей. Причина электрохимической коррозии-пониженная термодинамическая устойчивость большинства металлов и их стремление переходить в ионное состояние.
При электрохимической коррозии взаимодействие металла с окружающей средой характеризуется анодным и катодным процессами, протекающими на различных участках поверхности металла. Продукты коррозии образуются только на анодных участках.
Электрохимическая коррозия - результат работы коррозионных гальванических элементов. Она происходит следующим образом: на анодных участках протекает реакция окисления с образованием ионов металла Fe 2+ , а на катодных участках под влиянием кислорода образуется гидроокись (как результат протекания реакции кислородной деполяризации). Ионы Fe 2+ и ОН - направляются друг к другу и образуют нерастворимый осадок Fe(OH)2 , который может разлагаться на окись железа и воду. (Fe(OH) 2 ->Fe 2 О 3 +H 2 О). Высвобождающиеся при реакции окисления электроны от анодного участка по металлу изделия перетекают к катодному участку и участвуют в реакции восстановления.
Модель коррозионного микроэлемента представлена на рисунке 4.
С электрохимическим механизмом протекают следующие виды коррозионных процессов:
Коррозия в электролитах – коррозия металлов в жидких средах, проводящих электрический ток. В зависимости от вида электролита различают коррозию в растворах кислот, щелочей и солей (кислотная, щелочная, солевая), в морской, речной воде.
Состав электролита определяет механизм процесса коррозии, влияет на его кинетику и скорость. Например скорость коррозии уменьшается, если электролит содержит анионы или окислители, в результате взаимодействия с которыми на поверхности металла образуется пленка труднорастворимых солей.
Растворенный в электролите кислород оказывает тормозящее или ускоряющее воздействие на процесс коррозии металлов.
На процесс коррозии влияет и концентрация электролита. Практически во всех природных средах с ростом концентрации солей в электролите скорость коррозии сначала возрастает до некоторого максимума, а затем уменьшается в результате снижения растворимости кислорода и затруднения катодного процесса.
Температура электролита также оказывает влияние на скорость коррозии. Это обусловлено тем, что с повышением температуры возрастает электропроводность электролита. С ростом температуры электролита скорость коррозии иногда может возрасти в десятки и сотни раз.
Почвенная коррозия – коррозия подземных металлических сооружений под воздействием почвенного электролита. На поверхности металлических изделий, находящихся в контакте с почвенным электролитом, вследствие местных неоднородностей металла или электролита возникает большое количество коррозионных элементов, природа которых аналогично природе гальванических элементов.
Почвенная коррозия является наиболее распространенным видом электрохимической коррозии, оказывающей воздействие на подземные металлические сооружения. Почвы и грунты чрезвычайно разнообразны не только в пределах больших регионов, но даже и в пределах одного небольшого участка. Между почвой, самым поверхностным слоем земли, и грунтом четкой границы нет.
Биокоррозия – частный случай почвенной коррозии, протекающая под воздействием микроорганизмов, в результате жизнедеятельности которых образуются вещества, ускоряющие коррозионные процессы. В природе наиболее широко распространены сульфатвосстанавливающие анаэробные бактерии, в результате действия которых образуется сероводород, который, соединяясь с железом, дает сернистое железо. Сульфатвосстанавливающие анаэробные бактерии, обычно обитают в воде, грязи, сточных водах, нефтяных скважинах, донных осадках, почве, цементе. Наиболее благоприятной средой для развития этих бактерий являются почвы с (оптимально 6-7,5) при 25-30 0 С. Жизнедеятельность железных аэробных бактерий сопровождается выделением в качестве продуктов коррозии нерастворимой пленки гидроокиси железа.
Биокоррозия (обрастание подводных сооружений морскими растительными и животными организмами - мшанками, балянусами, диатомеями, кораллами) разрушает защитные покрытия и ускоряет разрушение металлов. Некоторые живые организмы (например, мидии) замедляют коррозионный процесс, так как потребляют много кислорода.
Атмосферная коррозия – коррозия металлов в атмосфере воздуха или в среде любого влажного газа. При отсутствии влаги в воздухе железо корродирует с незначительной скоростью.
Она зависит от степени увлажненности поверхности металлов и по этому признаку подразделяется на три типа:
1) мокрая атмосферная коррозия (при относительной влажности воздуха ~ 100 %) при наличии видимой пленки влаги на поверхности металла;
2) влажная атмосферная коррозия при наличии на поверхности металла невидимой пленки влаги, которая образуется при капиллярной адсорбционной или химической конденсации;
3) сухая атмосферная коррозия при полном отсутствии влаги на поверхности металла.
Атмосферы существенно различаются по влажности, температуре и загрязнению, поэтому скорость атмосферной коррозии в различных районах неодинакова, чем ближе к морскому побережью, тем больше воздух насыщен морской солью, в особенности NaCl. В промышленных областях в воздухе появляются значительные количества SO 2 , который превращается в серную кислоту. При работе двигателей внутреннего сгорания в большом количестве образуется NO, который выделяется в атмосферу. В городах и индустриальных центрах в атмосферу выделяется большое количество H 2 S.
По агрессивности атмосферы можно разделить на следующие основные типы: морскую, промышленную, городскую, сельскую, арктическую.
Специфическими факторами, влияющими, на агрессивность атмосферы являются (кроме газов) пыль и влага.
Пленки ржавчины, образующиеся в атмосферных условиях, могут иметь защитные свойства, поэтому скорость коррозии со временем снижается.
В реальных условиях все эти типы коррозии взаимно переходят друг в друга. Характер изменения скорости атмосферной коррозии в зависимости от толщины пленки влаги показан на рисунке. Эта скорость изменяется от нуля для сухой атмосферной коррозии, достигает максимума для влажной атмосферной коррозии и снижается до некоторого постоянного значения, характеризующего скорость коррозии данного металла в электролите.
На скорость атмосферной коррозии металлов влияет большое число факторов:
1) влажность воздуха (создание электролита);
2) примеси воздуха (газы SO 2 , SO 3 , K 2 S, NH 3 , СЬ- НС1 и др. в контакте с водой действуют как депассиваторы, комплексообразователи или катодные деполяризаторы; твердые частицы увеличивают электропроводность пленки электролита и облегчают адсорбцию газов и влаги из воздуха);
3) характер атмосферы (чистая, грязная, сухая, влажная);
4) географическая зона (тропики, субтропики, средняя полоса, пустым, полюс);
5) состояние поверхности корродирующего материала (наличие продуктов коррозии);
6) наличие инородных включений в металле (одни из них защищают от коррозии - катодные включения, например Си, Pb, Pd, а другие способствуют разрушению металла);
7) температура (с повышением температуры скорость коррозии влажность снижаются).
Методы защиты металлов от атмосферной коррозии сводятся следующему:
а) нанесению защитных покрытий (смазки, лаки, пленки, цинкование, никелирование, хромирование, фосфотирование, окисные пленки); б) воздействию на контролирующие процессы (пассивация анода Сг, Al, Ti, Ni, катодные включения Си, Pd); в) уменьшению слоя электролита на поверхности корродирующего металла (осушка и очистка воздуха); г) применению замедлителей коррозии (NaNО 2 , нитриты, карбонаты, бензоаты дициклогексиламина и моноэтаноламина) в основном при хранении металлов и транспортировании их в контейнерах или упаковке из оберточных материалов.
Электрокоррозия – коррозия подземных металлических сооружений, вызванная проникновением на сооружения токов утечки с рельсов электрифицированного транспорта или других промышленных электроустановок и сооружений (электрифицированные железные дороги, метрополитены, линии передачи постоянного тока, установки катодной защиты подземных металлических сооружений).
Эти токи получили название блуждающих, величина и направление их могут изменяться во времени.
Основной величиной, характеризующей интенсивность процесса электрокоррозии, являются сила тока, стекающего с подземного сооружения в грунт, отнесенная к единице поверхности.
Величина тока утечки с подземного сооружения зависит от многих факторов, в частности:
Удельное сопротивление земли;
Величина блуждающих токов в земле;
Взаимное расположение источников блуждающих токов и подземного сооружения;
Состояние внешнего изолирующего покрытия на подземном сооружении;
Продольное сопротивление подземного сооружения.
Контактная коррозия – коррозия, вызванная электрическим контактом двух металлов имеющих различный электрохимический потенциал.
Коррозия под напряжением возникает при одновременном воздействий коррозионной среды и механических напряжений в металле.
Щелевая коррозия – ускорение коррозионного разрушения металла электролитом в узких зазорах и щелях (в резьбовых и фланцевых соединениях).
Коррозионная эрозия – при одновременном воздействии коррозионной среды и трения.
Коррозионная кавитация возникает при одновременном коррозионным и ударном воздействии окружающей среды (коррозия лопаток рабочих колес центробежных насосов, разрушение лопаток гребных винтов на судах).
Фреттинг – коррозия представляет собой локальное коррозионное разрушение металлов при воздействии агрессивной среды в условиях колебательного перемещения двух трущихся поверхностей относительно друг друга.
Структурная коррозия обусловлена структурной неоднородностью сплава. При этом происходит ускоренный процесс коррозионного разрушения вследствие повышенной активности какого–либо компонента сплава.
Термоконтактная коррозия возникает за счет температурного градиента, обусловленна неравномерным нагреванием поверхности металла.
Химическая коррозия
Внешние факторы газовой коррозии. Газовая коррозия является частным случаем химической коррозии и возможна только в условиях, исключающих протекание электрохимических процессов. Характерной особенностью газовой коррозии является отсутствие на поверхности металла влаги. Поэтому в большинстве случаев речь идет о коррозии при повышенной температуре, при которой вода находится в газовой фазе. Однако, исходя из определения, можно представить себе газовую коррозию и при комнатной температуре, но в условиях высокой степени сухости, естественной или создаваемой искусственно. Так, при осушении силикагелем до точки росы – 30 °С влагоемкость воздуха составит 0,333 г/м 3 . При + 20 °С это соответствует влажности воздуха всего лишь 2 % . В таких усло-
виях протекание электрохимической коррозии практически исключается. В промышленности случаи газовой коррозии встречаются достаточно часто - от разрушения деталей, нагревательных печей до коррозии металла в процессе его термической обработки.
На скорость газовой коррозии влияет целый ряд факторов, и прежде всего такие, как температура и состав газовой среды.
Повышение температуры заметно увеличивает скорость коррозии. В первом приближении эта связь может быть описа-
на известным из физической химии уравнением Аррениуса
ln K = A -
где К - скорость реакции; А и В - константы; Т - абсолютная температура (°К) .
Из уравнения следует, что логарифм скорости коррозии линейно связан с величиной, обратной абсолютной температуре. Эта зависимость в некоторых случаях (например, для меди в интервале температуры 700 – 900 °С ) полностью подтверждается, но чаще она носит более сложный характер, что связано с влиянием вторичных реакций, природой и свойствами продуктов коррозии и др.
В среде чистого воздуха коррозия сводится к взаимодействию металла с кислородом. Железо уже при температуре 300 °С покрывается на воздухе окалиной, т. е. окисной пленкой, различимой невооруженным глазом. В состав окалины входит магнетит F 3 O 4 и гематит Fe 2 O 3 . С ростом температуры, вплоть до 575 °С , скорость коррозии остается примерно постоянной, но, начиная с 575 0 С , резко увеличивается. Этот факт связывают с появлением на границе металл - окалина вюстита (окиси железа FеО ).
На поверхности углеродистой стали в процессе коррозии параллельно протекают две группы реакций: окисление железа до окислов с образованием окалины и реакции обезуглероживания c участием карбида железа (цементита) по следующему уравнению:
Fe 3 C + O 2 → 3Fe + CO 2 .
Таким образом, поверхностный слой металла обедняется цементитом. При длительном нагреве глубина обезуглероженного слоя может составлять несколько миллиметров. Это заметно влияет на свойства металла, и прежде всего на его твердость и прочность. Обезуглероживание наблюдается и при наличии в газовой среде углекислого газа, паров воды или других окислителей и протекает по аналогичным реакциям:
Fe 3 C + СО 2 → 3Fе + 2СО,
Fe 3 C + Н 2 O → 3Fe + СО + Н 2 .
Повышение давления газа при прочих равных условиях также сильно ускоряет газовую коррозию.
Специфично влияет на коррозионную стойкость стали водород, вызывая при повышенной температуре и давлении так называемую водородную хрупкость, т. е. резкое снижение прочности. Водородная хрупкость объясняется не только обезуглероживанием стали за счет восстановления цементита водородом, но и такими явлениями, как молизация атомарного водорода, находящегося в кристаллической решетке стали, и образование по границам зерен металла паров воды и метана. Каждый из процессов приводит к генерированию газа, создающего в замкнутом объеме металла колоссальное давление. Это в свою очередь вызывает появление многочисленных микротрещин, понижающих прочность металла.
Газовой коррозии сильно подвержены и многие цветные
металлы, хотя каждый из них относится к тем или иным газам поразному. Это можно проиллюстрировать данными табл. 2, в которой скорость коррозии металлов для наглядности дана в относительных единицах, при этом скорость коррозии железа в кислороде принята за 100.
Табл. 9 убедительно демонстрирует влияние природы металла на скорость коррозии. Например, если при переходе от кислорода к парам воды коррозия вольфрама замедляется примерно в 20 раз, а меди - в 3,5 раза, то скорость коррозии железа при этом, наоборот, увеличивается.
Таблица 9
Газовая коррозия ряда металлов в некоторых средах
(температура 800 °С , продолжительность 24 ч )
Окисные пленки. Существенное влияние на скорость газовой коррозии оказывают образующиеся продукты коррозии, их физико - химические и механические свойства. В большинстве случаев коррозия протекает в окислительной среде; при этом на поверхности металла в качестве продукта коррозии образуется окисная пленка. Впрочем, тонкая окисная пленка на металле обычно появляется уже при комнатной температуре. Свойства образующейся окисной пленки решающим образом влияют на дальнейший ход коррозионного процесса. В случае резкого торможения процесса вплоть до полного прекращения коррозии говорят о наступившей пассивности поверхности металла.
Термодинамика газовой коррозии. Термодинамическая возможность процесса газовой коррозии с образованием окисной пленки определяется величиной изменения свободной энергии системы. Существует удобная форма определения термодинамической возможности протекания коррозии за счет окисления металла, которая сводится к сравнению упругости диссоциации полученного продукта реакции окисления с парциальным давлением кислорода в газовой фазе.
Действительно, если парциальное давление кислорода Р O и упругость диссоциации окисла Р MeO в реакции окисления металла mМе + nO 2 Ме m O 2 n будут равны, то реакция будет находиться в равновесии. Если Р O > Р MeO , то реакция протекает слева направо в сторону образования окисла. Если Р O < Р MeO , то окисел самопроизвольно диссоциирует на кислород и металл. Поэтому сравнение упругости диссоциации данного окисла при данной температуре, например, с парциальным давлением кислорода воздуха (Р O 0,2 ат при атмосферном давлении) позволяет найти границу термодинами
ческой вероятности процесса окисления металла на воздухе. Так, судя по данным табл. 10, серебро уже при 400 °К не способно окисляться. Для меди эта граница лежит в области 2000 °К .
Таблица 10
Упругость диссоциации окислов серебра и меди
в зависимости от температуры
| Процесс | 300 0 К | 400 0 К | 500 0 К | 800 0 К | 1200 0 К | 1600 0 К |
| Ag 2 O 2Ag + O 2 | 8,4 ∙ 10 -5 | 6,9 ∙ 10 -1 | - | - | - | |
| Cu 2 O 2Cu + O 2 | - | - | 0,56 ∙ 10 - 30 | 3,7 ∙ 10 - 16 | 2 ∙ 10 - 8 | 1,8 ∙ 10 - 4 |
Свойства окисных пленок. В зависимости от условий образования окисные пленки могут иметь толщину от мономолекулярной до нескольких миллиметров. Различаются тонкие, средние и толстые пленки. Тонкие пленки имеют толщину от нескольких ангстрем до 400 Å . Они невидимы и могут быть обнаружены и измерены так называемым оптическим методом отражения поляризованного света.
Средние пленки имеют толщину 400 - 5000 Å и видны невооруженным глазом благодаря возникновению цветов побежалости (явление интерференции света, известное из физики). Их толщина может быть измерена различными методами, среди которых наиболее доступные гравиметрический (весовой) и электрометрический (метод катодного восстановления).
Пленки толщиной выше 5000 Å (т. е. толще 0,5 мк ) определяются весовым методом или методом катодного восстановления, а также с помощью микроскопа, микрометра или других аналогичных мерительных инструментов. Обычно они легко обнаруживаются невооруженным глазом.
Следует отметить, что при изучении фазового состава и
структуры окисных пленок широко используются электронно-микроскопический, электронно-графический и рентгенографический методы исследования.
В табл. 11 даны примеры окисных пленок на железе. Обращает на себя внимание четкая зависимость толщины пленки от условий ее образования, а также сам диапазон толщины - от 15 Å до 0,6 мм .
Было бы ошибочным считать, что чем толще окисная пленка, тем она надежнее защищает металл от коррозии. В действительности дело обстоит скорее наоборот, а именно лучшими защитными свойствами обладают тонкие пленки. Однако толщина пленки, строго говоря, не является все же критерием защитной способности.
Чтобы окисная пленка обладала защитными свойствами, она должна быть прежде всего сплошной, беспористой. Условие сплошности окисной пленки было сформулировано Пиллингом и Бедворсом: если объем окисла металла меньше, чем объем металла, из которого пленка образовалась, то пленка
образуется несплошной; если объем окисла металла больше, чем объем металла, то пленка может быть беспористой, компактной.
Сказанное можно пояснить следующими неравенствами:
< 1 пленка не может быть сплошной; при > 1 пленка может быть сплошной.
В свою очередь
V Me = и V Me O = ,
где А - атомный вес металла (т. е. рассматривается грамм - атом металла); - плотность металла; М - молекулярный вес
окиси металла; n - число атомов металла в молекуле окиси; D - плотность окиси.
Таблица 11
Толщина окисной пленки на железе
в зависимости от условий
Условие сплошности является необходимым и существенным, но не единственным для характеристики защитных
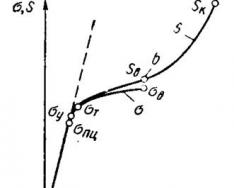
свойств окисной пленки. При слишком больших значениях V Ме O / V Ме плёнка испытывает столь высокие внутренние напряжения, что разрушается, теряя сплошность. Например, при отношении V WO / V W = 3,35 окисная пленка вольфрама имеет весьма слабые защитные свойства.
Пленка должна иметь хорошее сцепление с металлом, должна быть достаточно прочной и эластичной. Коэффициенты теплового расширения пленки и металла должны быть достаточно близки. Наконец, пленка должна быть химически стойкой в условиях воздействия на нее коррозионной среды.
Важным условием является и необходимость ориентаци-
онного соответствия образующейся пленки металлу. Сущность ориентационного соответствия сводится к требованию максимального сходства кристаллических решеток металла и образующегося окисла при минимальном смещении атомов. Чаще всего при наличии кристаллической структуры окисла, близкой структуре металла, защитные свойства такой пленки лучше, чем неориентированного по отношению к металлу окисла.
Законы роста окисных пленок. Если в результате коррозии образуется несплошная окисная пленка, кислород получает свободный доступ к поверхности металла. В этом случае скорость коррозии должна быть величиной постоянной:
где y - толщина окисной пленки. После интегрирования получим уравнение
y = k + А,
выражающее линейную зависимость толщины пленки от времени. Постоянная А указывает на наличие некоторой окисной пленки к моменту начала окисления (у = А при = 0 ). Как следует из уравнения, скорость роста пленки в этом случае не зависит от ее толщины. Коррозия может протекать с постоянной скоростью вплоть до полного превращения металла в окисел, как это имеет место при окислении магния в среде кислорода.
Однако нередко фактическая скорость окисления, сохраняя постоянство, оказывается ниже теоретической скорости химической реакции окисления металла. Это несоответствие объясняется наличием на границе раздела металл - окисел металла тончайшей, вплоть до нескольких мономолекулярных слоев, сплошной пленки псевдоморфного окисла. Псевдоморфный окисел обладает высокой степенью ориентационного соответствия металлу и является, таким образом, своеобразным кристаллографическим продолжением решетки окисляемого металла, отличаясь в то же время по параметрам от решетки окисла металла. Будучи беспористым, он затрудняет проникновение кислорода к поверхности металла.
Таким образом, даже в случае образования на металле толстой и рыхлой окисной пленки скорость коррозии в конечном итоге будет лимитироваться не скоростью реакции окисления, а скоростью диффузии кислорода сквозь компактный псевдоморфный окисел.
Если в процессе коррозии образуется окисел, обладающий достаточно хорошими защитными свойствами, то скорость коррозии будет зависеть от соотношения скоростей взаимной диффузии сквозь пленку атомов кислорода к поверхности металла и атомов металла к поверхности раздела фаз окисел - газ. Можно показать, что в этом случае по мере роста толщины пленки скорость коррозии будет замедляться по уравнению
После интегрирования и объединения констант получаем параболическую зависимость толщины окисной пленки от продолжительности коррозии:
y 2 = k + А.
Такая зависимость наблюдается при окислении меди, никеля, вольфрама. Имея параболическую кривую зависимости коррозии от времени, можно определить скорость коррозии в любой точке кривой. Она будет выражаться как тангенс угла наклона касательной, проходящей через данную точку, так как
tg = .
Наконец, в некоторых условиях торможение скорости окисления металла с ростом толщины окисной пленки происходит более интенсивно, чем этого требует параболический закон. В этих случаях скорость окисления связана с толщиной пленки экспоненциальной зависимостью
После интегрирования приходим к логарифмическому уравнению
у = ln (k ).
Логарифмический закон роста пленки имеет экспериментальное подтверждение при окислении на воздухе алюминия и цинка в интервале температуры 20 – 255 °C , меди - до 100 °С , железа до 385 °С .
Важно подчеркнуть, что закономерности роста пленки на металле могут меняться в зависимости от условий. Так, окисление железа при температуре ниже 385 °С подчиняется логарифмическому закону, в области выше этой температуры и до 1000 °С - параболическому, а при давлении кислорода ниже 1 мм рт. ст. и температуре 700 - 950 °С - линейному.
Разрушение пленок. В процессе роста окисной пленки в ней возникают значительные внутренние напряжения. Поэтому, если образующаяся пленка недостаточно прочна или имеет слабое сцепление с металлом, или слишком неэластична, или по другим причинам, затронутым выше (например, различие коэффициентов температурного расширения металла и пленки), она разрушается. Характер разрушения связан с причиной, вызвавшей его. Если прочность пленки велика, а сцепление с металлом недостаточно хорошее, образуются пузыри. Крупные пузыри приводят обычно к разрывам (рис. 68, а ), и защитные

а б в г д
Рис 68. Виды разрушения окисных пленок.
а - пузырь с разрывом; б - микропузыри в слое окисла (вакуумная пористость); в - отслаивание; г - растрескивание при
сдвиге; д - растрескивание на углах и ребрах.
свойства пленки резко снижаются. В других случаях образуются мелкие пузыри в слое окисла (рис. 68, б ), и тогда защитные свойства пленки могут даже возрасти, так как подобная «вакуумная пористость» препятствует диффузии реагирующих атомов или ионов и таким образом тормозит процесс коррозии. Может наблюдаться отслаивание окисла (рис. 68, в ), а также растрескивание на поверхности (рис. 68, г ) или на углах и ребрах (рис. 68, д ).
Методы защиты от газовой коррозии. Основной метод защиты от газовой коррозии сводится к применению легированных сплавов, обладающих так называемой жаростойкостью. Для снижения скорости окисления железа при 900 °С вдвое достаточно ввести 3,5 % алюминия, а вчетверо - около 5,5 % . Концентрация легирующего компонента может быть ничтожной. Так, расплавленный магний настолько энергично окисляется на воздухе, что способен самовозгораться. Однако при введении всего лишь 0,001 % бериллия скорость окисления магния резко снижается.
Действие легирующих элементов объясняется образованием на поверхности металла защитных пленок. Они или образуются только из легирующего компонента, или состоят из смешанных окислов легирующего компонента и основного металла. Наилучшими защитными свойствами обладают окислы типа шпинелей. Шпинельная структура окисла характеризуется высокой степенью компактности ионов в решетке и практическим отсутствием вакантных узлов; это и обусловливает их высокую термодинамическую стабильность. Примером шпинелей являются окислы FeO ∙ Сr 2 О 3 на поверхности хромистой стали или NiO ∙ Сr 2 О 3 на поверхности хромо - никелевой стали.
Второй метод борьбы с газовой коррозией - применение защитной атмосферы. В зависимости от природы металла газовая среда не должна содержать окислителей (для стали) или, наоборот, восстановителей (для меди). В ряде случаев применяются инертные газы - азот, аргон. На практике этот метод встречается только в специальных случаях: при термообработке и сварке. Так, отжиг стали проводят в атмосфере, содержащей смесь азота, водорода и окиси углерода. Сварка алюминиево-магниевых и титановых деталей протекает успешно в атмосфере аргона.
Третий метод снижения скорости газовой коррозии - защита поверхности металла специальными жаростойкими по
крытиями. В одних случаях поверхность, например стальной детали покрывают термодиффузионным способом сплавом железо - алюминий или железо - хром. Оба сплава обладают высокими защитными свойствами, а сам процесс называется
соответственно алитированием и термохромированием. В других случаях поверхность защищают слоем кермета - смесью металла с окислами. Керамико - металлические покрытия (керметы) интересны тем, что сочетают тугоплавкость, твердость и жаростойкость керамики с пластичностью и проводимостью металла. В качестве неметаллической составляющей используют тугоплавкие окислы Al 2 O 3 , MgO и соединения - типа карбидов и нитридов. Металлическим компонентом служат металлы группы железа, а также хром, вольфрам, молибден.
Среди всех существующих видов разрушения металлов наиболее часто встречается электрохимическая коррозия, которая возникает в результате его взаимодействия с электролитически проводящей средой. Основная причина данного явления – это термодинамическая неустойчивость металлов в средах, которые их окружают.

Этому виду коррозии подвержены многие объекты и конструкции:
- газовые и водные трубопроводы;
- элементы транспортных средств;
- другие конструкции, изготовленные из металла.
Коррозийные процессы, то есть, ржавчина, могут возникать в атмосфере, в грунте, и даже в соленой воде. Очистка металлоконструкций от проявлений электрохимической коррозии является сложным и длительным процессом, поэтому проще предотвратить ее возникновение.
Основные разновидности
При коррозии в электролитах происходит преобразование химической энергии в электрическую. В связи с этим ее называют электрохимической. Принято различать следующие виды электрохимической коррозии.
Межкристаллитная
Под межкристаллитной коррозией подразумевается такое опасное явление, при котором происходит разрушение границ зерна никеля, алюминия и других металлов избирательным образом. Как следствие, прочностные и пластичные свойства материала утрачиваются. Главная опасность этой разновидности коррозии в том, что далеко не всегда она заметна визуально.

Питтинговая
Питтинговая электрохимическая коррозия представляет собой точечное поражение отдельных участков поверхности меди и других металлов. В зависимости от характера поражения, различают закрытый, открытый, а также поверхностный питтинг. Размеры пораженных участков могут варьироваться от 0,1 мм до 1,5 мм.

Щелевая
Щелевой электрохимической коррозией принято называть усиленный процесс разрушения металлических конструкций в местах расположения щелей, зазоров и трещин. Протекание щелевой коррозии может происходить в воздушной атмосфере, газовых смесях, а также морской воде. Данный вид разрушения характерен для газопроводов, днищ морских судов и многих других объектов.
Распространено протекание коррозии в условиях небольшого количества окислителя из-за затрудненного подхода к стенкам щели. Это приводит к накоплению коррозийных продуктов внутри зазоров. Электролит, содержащийся во внутреннем пространстве зазора, может изменяться под воздействием гидролиза продуктов коррозии.

С целью защиты металлов от щелевой коррозии принято применять несколько методов:
- уплотнение зазоров и щелей;
- электрохимическая защита;
- процесс ингибирования.
В качестве профилактических методов следует использовать только те материалы, которые в наименьшей степени подвержены возникновению ржавчины, а также изначально грамотно и рационально конструировать газопроводы и другие важные объекты.
Грамотная профилактика во многих случаях представляет собой более простой процесс, чем последующая очистка металлоконструкций от въевшейся ржавчины.
Как проявляется коррозия разных видов
В качестве примера протекания коррозийного процесса можно привести разрушение различных приборов, компонентов автомобилей, а также любых конструкций, произведенных из металла и расположенных:
- в атмосферном воздухе;
- в водах – моря, реки, содержащиеся в почве и под слоями грунта;
- в технических средах и т.д.

В процессе ржавления металл становится многоэлектронным гальваническим элементом. Так, например, если в электролитической среде происходит контакт меди и железа, медь является катодом, а железо – анодом. Отдавая электроны меди, железо в виде ионов попадает в раствор. Ионы водорода начинают двигаться по направлению к меди и там разряжаются. Становясь все более и более отрицательным, катод вскоре приравнивается к потенциалу анода, в результате чего коррозийный процесс начинает замедляться.
Разные виды коррозии проявляются по-разному. Более интенсивно электрохимическая коррозия проявляется в тех случаях, когда в катоде присутствуют вкрапления металла с меньшей активностью по сравнению с корродирующим – на них ржавчина появляется быстрее и является довольно выразительной.
Протекание атмосферной коррозии происходит в условиях влажного воздуха и обычной температуры. В данном случае на поверхности металла образуется пленочка из влаги с растворенным кислородом. Процесс разрушения металла становится интенсивнее по мере увеличения влажности воздуха и содержания газообразных оксидов углерода и серы при условии наличия:
- трещин;
- шероховатостей;
- других факторов, провоцирующих облегчения процесса конденсации.

Почвенная коррозия в наибольшей степени поражает разнообразные подземные сооружения, газопроводы, кабели и другие конструкции. Разрушение меди и других металлов происходит по причине их тесного соприкосновения с почвенной влагой, в составе которой также присутствует растворенный кислород. Разрушение трубопроводов может произойти уже спустя полгода с момента их строительства в том случае, если для почвы, в которой они установлены, характерна повышенная кислотность.
Под воздействием блуждающих токов, исходящих от посторонних объектов, возникает электрическая коррозия. Ее главными источниками являются электрические железные дороги, линии электропередач, а также специальные установки, функционирующие на постоянном электротоке. В большей степени данный вид коррозии провоцирует разрушение:
- газопроводов;
- всевозможных сооружений (мосты, ангары);
- электрокабелей;
- нефтепроводов.
Действие тока провоцирует возникновение участков входа и выхода электронов – то есть, катодов и анодов. Наиболее интенсивным разрушительный процесс является именно на участках с анодами, поэтому на них ржавчина более заметна.
Коррозия отдельных компонентов газопроводов и водяных трубопроводов может быть вызвана тем, что процесс их инсталляции является смешанным, то есть, происходит с использованием различных материалов. Наиболее частыми примерами является точечная коррозия, возникающая в элементах из меди, а также коррозия биметаллов.
При смешанной установке железных элементов со сплавами меди и цинка, процесс коррозии отличается меньшей степенью критичности, чем при медном литье, то есть со сплавами меди, цинка и олова. Предотвратить коррозию трубопроводов можно, используя специальные методы.

Способы защиты от ржавления
Для борьбы с коварной ржавчиной применяются различные методы. Рассмотрим те из них, который являются наиболее эффективными.
Способ №1
Один из самых популярных методов – это электрохимическая защита чугуна, стали, титана, меди и других металлов. На чем же она основывается?
Электрохимическая обработка металлов представляет собой особый способ, направленный на изменение формы, размеров и шероховатости поверхности путем анодного растворения в электролите под воздействием электротока.
Чтобы обеспечить надежную защиту от ржавчины, необходимо еще перед началом эксплуатации металлических изделий обрабатывать их особым средствами, которые в своем составе содержат различные компоненты органического и неорганического происхождения. Данный метод позволяет предотвратить появление ржавчины на определенное время, однако позже придется обновлять покрытие.

Электрозащита представляет собой процесс, при котором металлическая конструкция подключается к внешнему источнику постоянного электрического тока. В результате этого на ее поверхности формируется поляризация электродов катодного типа, и все анодные области начинают преобразовываться в катодные.
Электрохимическая обработка металлов может происходить с участием анода или катода. В некоторых случаях происходит попеременная обработка металлического изделия обоими электродами.
Катодная защита от коррозии необходима в тех ситуациях, когда у металла, подлежащего защите, не наблюдается предрасположенность к пассивации. К металлическому изделию подключается источник внешнего тока – специальная станция катодной защиты. Данный метод подходит для защиты газопроводов, а также трубопроводов водоснабжения и отопления. Однако есть у этого метода определенные недостатки в виде растрескивания и разрушения защитных покрытий – это происходит в случаях значительного смещения потенциала объекта в отрицательную сторону.
Способ №2
Электроискровая обработка металлов может осуществляться при помощи установок различных типов – бесконтактной, контактной, а также анодно-механической.
Способ №3
Для надежной защиты газопроводов и других трубопроводов от ржавчины часто применяется такой метод, как электродуговое напыление. Преимущества данного способа очевидны:

- значительная толщина защитного слоя;
- высокий уровень производительности и надежности;
- применение относительно недорогого оборудования;
- несложный технологический процесс;
- возможность применения автоматизированных линий;
- невысокие энергетические затраты.
Среди недостатков данного метода – невысокая эффективность при обработке конструкций в коррозийных средах, а также недостаточная прочность сцепления со стальной основой в некоторых случаях. В любых других ситуациях такая электрозащита очень эффективна.
Способ №4
Для защиты разнообразных металлических конструкций – газопроводов, мостовых сооружений, всевозможных трубопроводов – требуется эффективная антикоррозийная обработка.

Данная процедура осуществляется в несколько этапов:
- тщательное удаление жировых отложений и масел с применением эффективных растворителей;
- очистка обрабатываемой поверхности от солей, растворимых в воде, – выполняется при помощи профессиональных аппаратов высокого давления;
- удаление имеющихся конструкционных погрешностей, выравнивание кромок – это необходимо для предотвращения сколов наносимого лакокрасочного покрытия;
- тщательная очистка поверхности при помощи пескоструйного аппарата – это делается не только для удаления ржавчины, но и для придания нужной степени шероховатости;
- нанесение противокоррозийного материала и дополнительного защитного слоя.
Правильная предварительная обработка газопроводов и всевозможных металлоконструкций обеспечит им надежную защиту от электрохимической коррозии в процессе эксплуатации.
Документы